

1.帕博利珠單抗與MSI-H/dMMR
高微衛星不穩定性或錯配修復基因缺陷型(MSI-H/dMMR)癌細胞擁有比正常細胞更多的遺傳標記物,被稱之為 “微衛星”。它們是短的重復性DNA序列。通常當細胞復制DNA時會修復錯配的 DNA,擁有大量微衛星的癌細胞可能在這一功能上有缺陷(也被稱之為錯配修復缺陷,或dMMR)。MSI-H/dMMR腫瘤最常見于子宮內膜癌、結直腸癌和胃腸癌,也可能出現在乳腺癌、前列腺癌、膀胱癌及胸腺癌患者中。
2017年5月,FDA批準帕博利珠單抗用于高度微衛星不穩定性(MSI-H)或錯配修復缺陷(dMMR)的實體腫瘤患者。
2.拉羅替尼(larotrectinib)與NTRK基因融合
神經營養性酪氨酸受體激酶(NTRK)是目前首個被發現并被認可的全癌種共發的可用藥的突變基因,在多種腫瘤中都有發現,在常見腫瘤肺癌、結直腸癌中的發病率低于5%,但多出現于成人和兒童實體瘤中,包括乳腺類似物分泌癌(MASC)、甲狀腺癌、結腸癌、肺癌、胰腺癌、及各種肉瘤等。
FDA在2018 年11 月批準了拜耳/Loxo 的拉羅替尼(Larotrectinib,商品名:Vitrakvi)。
根據2021年ASCO的最新研究進展來看,在一個3項臨床試驗中,共納入了218例患者接受larotrectinib治療,其中206例可評價療效。有21種不同的腫瘤類型,其中肺癌占總比例的9%。患者的中位年齡為38.0歲。所有患者均接受過大量預治療,45%的患者既往接受過≥二線的全身治療;27%的患者既往接未接受過全身治療。其中ORR為75%(95%CI 68-81):CR為22%,PR為53%,SD為16%,PD為6%;中位緩解持續時間(DoR)為49.3個月(95%CI 27.3–無法估計);中位PFS為35.4個月(95%CI 23.4-55.7);未達到中位總生存期(OS)。
3.恩曲替尼(entrectinib)與NTRK基因融合
2019年8月15日,FDA宣布批準entrectinib(恩曲替尼)上市,用于治療NTRK基因融合陽性的晚期復發實體瘤成人和兒童患者,同時,FDA還批準恩曲替尼用于治療攜帶ROS1基因突變的轉移性非小細胞肺癌。柳葉刀發表文章匯總了三個I/ II期研究中鑒定并分析了總共54例先前未接受TRK靶向治療的NTRK融合陽性腫瘤患者。整體人群的ORR為57.4%(31/54),中位無進展生存期(PFS)和總體生存期(OS)分別為11.2個月和20.9個月。
4.帕博利珠單抗與TMB-H
腫瘤突變負荷(tumor mutational burden, TMB):是測量某種腫瘤體細胞內編碼蛋白的平均1Mb范圍內的堿基突變數量,包括基因編碼錯誤、堿基替換、基因插入或缺失等各種形式的突變。
2020年,FDA批準帕博利珠單抗“不限癌種”的新適應癥:單藥治療不可切除或轉移性的,具有高組織腫瘤突變負荷(TMB-H)≥10個突變/Mb的,成人和兒童實體瘤患者(既往治療后疾病進展且沒有更佳替代療法)。
5.多塔利單抗(dostarlimab-gxly)與dMMR
2021年8月18日,FDA加速批準了dostarlimab-gxly (Jemperli) 用于治療實體瘤免疫治療中錯配修復缺陷(dMMR)成人患者。
此次獲批是基于一項正在進行的、多中心、非隨機、多個平行隊列、開放標簽的研究GARNET 試驗,其中的dMMR子宮內膜癌隊列 A1 和 dMMR 實體瘤、非子宮內膜癌隊列 F 正在進行的 GARNET 1 期試驗 (NCT02715284) 的數據基礎。納入A1 隊列的患者需要在先前使用含鉑方案治療時或之后出現進展,入選隊列 F 的患者必須在全身治療后取得進展,并且沒有獲得任何令人滿意的替代治療選擇,結直腸癌患者在使用氟嘧啶、奧沙利鉑和伊立替康后疾病進展或不耐受。
研究結果表明,該藥物在所有 dMMR 實體瘤[包括子宮內膜和非子宮內膜實體瘤(n = 209)]客觀緩解率(ORR)為41.6%(95% CI,34.9-48.6),其中部分緩解 (PR) 率32.5%;中位反應持續時間 (DoR) 為34.7個月(范圍 2.6-35.8+),95.4%的患者出現反應持續6個月或更長時間。
6.達拉非尼+曲美替尼與BRAF
2022年6月,FDA 已加速批準達拉非尼 (Tafinlar) 聯合曲美替尼 (Mekinist) 用于治療 6 歲及以上 BRAF V600E 突變的不可切除或轉移性實體瘤患者。在2期ROAR 籃子試驗 (NCT02034110) 和 NCI-MATCH 研究 (NCT02465060) 的 H 組中,雙聯療法治療BRAF V600E 突變實體瘤患者的總體反應率高達 80%,包括神經膠質瘤、膽道癌、婦科腫瘤和胃腸道腫瘤等。
7.塞爾帕替尼與RET
2022年9月,FDA基于2022年6月ASCO年會上公布的LIBRETTO-001研究結果,加速批準selpercatinib(塞爾帕替尼)用于治療攜帶RET基因融合的局部晚期或轉移性實體瘤成人患者,這些患者在之前的全身系統治療期間或之后出現進展,或者沒有令人滿意的替代治療選擇。
LIBRETTO-001試驗共招募806名患者,其中45名為RET融合陽性的泛實體瘤患者,覆蓋14種獨特的腫瘤類型(排除肺癌和甲狀腺癌),其中4名患者因不符合隨訪時間標準被排除,最終納入41名RET融合陽性患者進行療效分析:總體ORR為 44%,DOR為 24.5個月。
該研究表明:RET基因融合不僅是肺癌和甲狀腺癌的致癌驅動因素,也是其他癌癥的致癌驅動因素,并且無論腫瘤類型如何,selpercatinib都是RET融合陽性癌癥的潛在有效治療方法。因此,將selpercatinib定位為一種泛實體瘤療法,并且重申了在泛實體瘤中考慮進行RET基因融合檢測的重要性。


全國共有49家實驗室報名參加,其中45家提交有效結果,僅23家通過評價活動,通過率為51.1%。

由中國臨床腫瘤學會(CSCO)主辦的"2020年中國臨床腫瘤學年度進展研討會"近日于線上順利召開,會上專家學者們對2020CSCO消化道腫瘤指南更新做了總結,近幾年頗受關注的免疫治療在新版指南中地位突顯,地位相較于舊版指南有所提升。
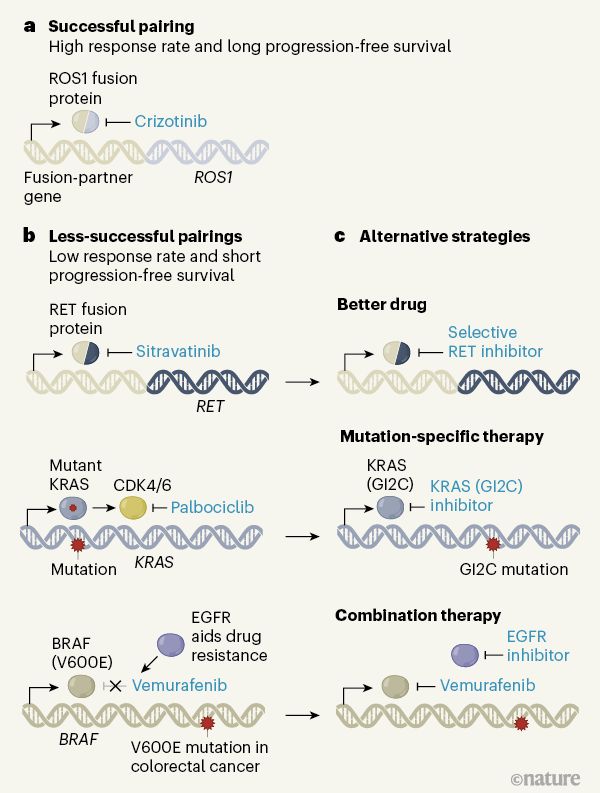
由伯明翰大學癌癥研究中心英國臨床試驗小組領導的一項開拓性的肺癌研究強調了下一波精準醫學研究,特別是治療基因組復雜癌癥需要考慮的重要因素。